2022辽宁高考化学模拟试卷
满分:100分考试时间:90分钟
第I卷(选择题,共60分)
可能用到的相对原子质量:H—1C—12N—14O—16Na—23S—32
Cl—35.5K—39Fe—56Cu—64
第I卷(共60分)
一、单选题(共20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1. 下列物质按氧化物、酸、碱、盐、混合物的顺序排列的是()
A.水、碳酸、硫酸铁、碳酸钠、空气
B.五氧化二磷、盐酸、氢氧化钙、硝酸镁、胆矾
C.氯酸钾、硝酸、氢氧化铜、硫酸亚铁、天然气
D.氧化铁、磷酸、氢氧化钾、氯化钠、石油
2.下列实验中,没有颜色变化的是 ()
A.葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热
B.淀粉溶液中加入碘酒
C.淀粉溶液中加入稀硫酸并加热
D.鸡蛋清中加入浓硝酸
3.下列说法正确的是()
A.氧化钙、氧化镁、氧化铝都属于碱性氧化物
B.生铁、水银和黄铜都属于合金
C.萃取操作时,选择的萃取剂与水不互溶,且萃取剂的密度必须比水大
D.用长滴管往硫酸亚铁溶液中滴入氢氧化钠溶液,会观察到先产生白色沉淀,逐渐变为灰绿色,最后呈现红褐色
4.一定量的质量分数为14%的KOH溶液,若蒸发掉100 g水后,其质量分数变为28%,体积为125 mL,且蒸发过程中无晶体析出,则浓缩后的KOH溶液的物质的量浓度为 ()
A.2.2 mol·L-1B.4 mol·L-1
C.5 mol·L-1D.6.25 mol·L-1
5.能正确表示下列反应的离子方程式为 ()
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C.大理石溶于醋酸中:
CaCO3 +2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
D.向AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓
6.设NA代表阿伏加德罗常数的数值,下列说法正确的是()
A.10 mL 18.4 mol•L-1浓硫酸与足量锌反应,转移电子数为 0.2NA
B.0.1 mol24Mg18O 晶体中所含中子总数为 2.0 NA
C.在标准状况下,2.8g N2 和 2.24L CO 所含电子数均为 1.4NA
D.1 L 1 mol•L-1的 NaClO 溶液中含有 ClO-的数目为NA
7.已知25%的A溶液的密度为ρ1,5%的A溶液的密度为ρ2,若将上述两种溶液等体积混合后,所得A溶液的质量分数小于15%,则下列关于ρ1和ρ2关系的表达正确的是 ()
A.ρ1<ρ2B.ρ1=ρ2C.ρ1>ρ2D.无法估算
8.NA表示阿伏加德罗常数。下列说法正确的是()
A.标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子
B.1mol苯乙烯中含有的碳碳双键数为4NA
C.1molNaCl晶体中含有NA个NaCl分子
D.28g乙烯分子中含有极性共价键的数目为4NA
9.分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是()
A.H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物
B.HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸
C.赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石
D.Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物
10.下列离子方程式书写正确的是()
A.偏铝酸钠中通足量的CO2:2AlO2- + CO2 + 3H2O=2Al(OH)3↓ + CO32-
B.铜制印刷电路板:3Cu + 2Fe3+ =3Cu2+ + 2Fe
C.SO2气体通入氯水中:SO2 + Cl2 + 2H2O = 4H+ + Cl-+ SO42-
D.向水玻璃中滴加盐酸:Na2SiO3 + 2 H+ = H2SiO3 ↓+ 2Na+
11.下列各组离子在给定条件下一定能大量共存的是()
A. 能使酚酞显红色的溶液中:Cu2+、 Fe3+、NO3-、SO42-
B. 含有大量NO3-的溶液中:NH4+、I-、SO42-、H+
C. 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
D. 在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、SO42-、AlO2-、K+
12.在下列溶液中能大量共存的离子组是 ()
A.Fe3+、Na+、Cl-、SCN-B.HCO3-、Ca2+、CO32-、K+
C.Na+、AlO2-、NO3-、H+D.K+、Na+、Cl-、SO42-
13.设NA为阿伏伽德罗常数的值,下列说法正确的是()
A.标况下,将5.6g铁片投入足量浓硝酸中生成6.72L NO2气体
B.lmolFeBr2与1.2mol Cl2反应转移的电子数为2.4mol
C.1L 1mol·L-1的草酸溶液中含有的H+数为2NA
D.标准状况下,2.24L乙醇中碳氢键的数目为0.5NA
14.某同学按下图所示的步骤配制50mL 一定物质的量浓度的NaOH溶液,其中不正确的操作有()
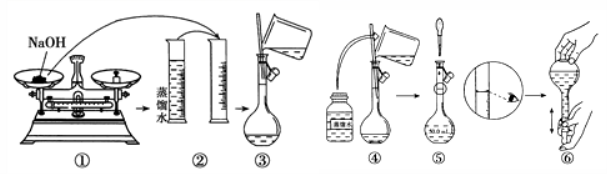
A.2项B.3项C.4项D.5项
15.设NA表示阿伏加德罗常数的值,下列说法正确的是
![]()
A.常温下,1.0L1.0mol·L-1KAlO2溶液中含有的氧原子数为2NA
B.7.8gNa2O2固体中含有的阴离子数为0.2NA
C.标准状况下,体积为2.24L的CO2和SO2的混合气体中含有的氧原子数为0.2NA
D.0.1molCl2参加氧化还原反应,转移的电子数目一定是0.2NA
16.将标准状况下的aL氯化氢气体溶于1L水(水的密度为1g/cm3)中,得到的盐酸的密度为bg/cm3,则该盐酸的物质的量的浓度是()
A.
![]()
![]()
C.
![]()
![]()
17.下列叙述正确的是()
A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L
D.配制1 L 0.2 mol/L的CuSO4溶液,需用25 g胆矾
18. 设NA为阿伏加德罗常数的值。下列说法正确的是()
A.一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6NA
B.1 L 0.1 mol·L-1的Na2CO3溶液中阴离子的总数大于0.1NA
C.向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA
D.1 mol-CH3中所含的电子总数为10NA
19.设NA表示阿伏加德罗常数的值,下列判断正确的有()
①标准状况下,22.4LSO3中含有的原子数目为4NA
②在常温常压下,48g 氧气和臭氧的混合气体含氧原子数是3NA
③1molCl2参加反应转移电子数一定为2NA
④ lmolNa2O2与水充分反应转移的电子数为2NA
⑤ 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA
⑥ 4℃时,22.4 L水中含有的电子数目为 10 NA个
⑦使2.3g钠变为 Na+,需失去0.1NA个电子
⑧10g46%乙醇水溶液中所含氢原子数目为0.6NA
A.2项B.3项C.4项D.5项
20.NA表示阿伏加德罗常数的数值,下列说法正确的是()
A.在标准状况下,11.2L NO2含有的分子数目为0.5NA
B.常温常压下,0.5 mol氦气含有的原子数为NA
C.常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D.高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
第Ⅱ卷(填空题,共40分)
二、填空题(共40分)
21.(20分)
(1)有以下四种物质 ①22gCO2;②5gH2;③1.204╳1024个N2;④4℃时18gH2O,它们所含分子数最多的是;质量最大的是;常温时体积最大的是(填序号)。
(2)在标准状况下,448mL某气体的质量为0.64g,则这种气体的相对分子质量为
(3) 某FeCl3和NaCl的混合液,已知c(Fe3+)= 0.2 mol·L-1,c(Cl-)= 1 mol·L-1,则c(Na+)=______________(忽略H+和OH-浓度)
(4) VL Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为
(5) 在无土栽培中,配置1L含5mol NH4Cl、1.6mol KCl、2.4mol K2SO4的营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为_______、_______
(6) 已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑,氧化剂与还原剂的物质的量之比是_________,HCl在反应中表现的性质有___________
22.(10分)现用质量分数为98%、密度为1.84g·cm-3的浓H2SO4来配制400 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙⑤量筒 ⑥容量瓶 ⑦托盘天平 。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时还欠缺的仪器是
(2)经计算,需量取浓H2SO4的体积为mL
(3)请用文字叙述实验过程中的定容操作:继续加水至距刻度线
,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)在配制过程中,下列操作中,能引起误差偏高的有(填代号)。
A.定容时,俯视刻度线
B.稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中并定容
C.摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
D.转移前,容量瓶中含有少量蒸馏水
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)=。
23.(10分)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
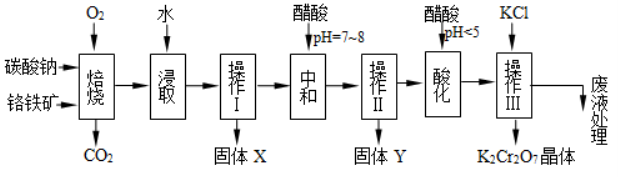
已知:① Na2CO3+Al2O3
![]()
② Cr2O72-+ H2O
![]()
根据题意回答下列问题:
(1)请完成下列化学方程式的配平:
__FeO•Cr2O3 + __Na2CO3 + __O2
![]()
(2)固体X的主要成分是_______
(3)酸化步骤用醋酸调节溶液pH<5,其目的是__________
(4)操作Ⅲ由多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、、过滤、______、干燥
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化成乙醛,自身被还原为三价铬离子。
该反应的离子方程式为